1) Nos brinda la temperatura y g de soluto cada 100 g de agua (l).
2) Que a mayor temperatura va a haber mayor solubilidad.
3) Quedaría una solución aguada, con soluto totalmente disuelto.
4) Se va a transformar en una solución diluida (sistema homogéneo).
5) Sería 35g de soluto.
6) Solución saturada.
7) Quedará soluto sin disolver totalmente.
8) Va a quedar un sistema heterogéneo, solución saturada con soluto sin disolver.
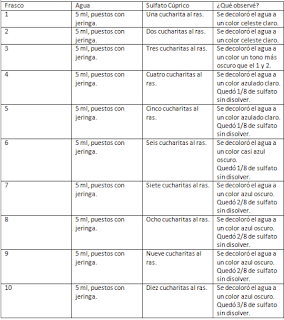
Ejercicio
1) NH4 Cl
2) Es más soluble 110g de H2O, que sería el soluto KNO3.
3) Es menos soluble a 5g de H2O, que sería el soluto SO2.
4) A medida que en el amoníaco aumenta la temperatura la solubilidad es menor, y el nitrato de sodio cuando aumenta la temperatura su solubilidad es mayor.
5) Gases: HCl Sólidos: Kl KClO3
NH3 NaNO3 NaCl
SO2 KNO3
NH4Cl
KCl
6) La razón por la cual son necesarias bajas temperaturas para solubilidad del gas es que la temperatura es una medición de la entropía, o desorden ocasionado por la energía cinética de las moléculas de líquido y gas. Con baja entropía, los gases pueden formar débiles enlaces moleculares con las moléculas de agua. A medida que la temperatura aumenta, estos enlaces son muy débiles como para contrarrestar el movimiento de las moléculas. Como resultado, cuando la temperatura aumenta las moléculas de gas se elevan hacia la superficie y escapan dentro de la atmósfera.Una causa de confusión con respecto a cómo la temperatura afecta la solubilidad es que la regla se invierte para los solventes sólidos en el agua. A medida que la temperatura del agua aumenta, la solubilidad de una materia sólida aumenta. Esto es debido a que la entropía aumentada rompe los enlaces moleculares que mantiene unida a la materia sólida, ocasionando que se disuelvan dentro de una solución. Esta es la razón por la cual es más fácil disolver una taza de azúcar en agua caliente que en agua fría.
Problemas
1) Porque la solubilidad del azúcar aumenta a mayor temperatura, y disminuye a menor temperatura.
2) Calentar el agua.
3) O°C 100g H2O disuelve 38g NaCl (sal)
100g -------- 38g
838,75 a ------- x
550 x 305 x 5= 838,75
939,75 x 38 % 100= 318,725g.
La máxima cantidad es 318,725g.
Problemas
1) Porque la solubilidad del azúcar aumenta a mayor temperatura, y disminuye a menor temperatura.
2) Calentar el agua.
3) O°C 100g H2O disuelve 38g NaCl (sal)
100g -------- 38g
838,75 a ------- x
550 x 305 x 5= 838,75
939,75 x 38 % 100= 318,725g.
La máxima cantidad es 318,725g.