https://drive.google.com/drive/recent
Pd: Esta subido desde google drive porque no se podia subir desde una entrada común.
jueves, 14 de diciembre de 2017
viernes, 1 de diciembre de 2017
viernes, 24 de noviembre de 2017
lunes, 13 de noviembre de 2017
viernes, 10 de noviembre de 2017
jueves, 9 de noviembre de 2017
viernes, 27 de octubre de 2017
E.S.I + T.I= SEXTING
SEXTING
La palabra sexting es un neologismo tomado de la lengua inglesa compuesto por las voces inglesas “sex” y “texting”; sexting alude al envío de mensajes con contenido de tipo pornográfico y/o erótico a través de los teléfonos celulares. Es decir es aquel acto de emitir mensajes sumamente explícitos que incluyen un contenido lascivo o libertino a través de un teléfono móvil; sin embargo desde cierto tiempo también el sexting incluye en envió y recepción de videos e imágenes fotográficas, a las que también se les denomina como “selfies”, donde las personas muestran sus partes sexuales.10 consejos para que sepas cómo evitar el sexting
1) No accedas a chantajes.
2) Evitá contactar con desconocidos.
3) Denuncia el Sexting.
4) No compartas información o fotografías comprometedoras.
5) Si te piden, nunca envíes ni te saces fotografías que pudieran afectar tu reputación.
6) Deberás saber que tus fotografías pueden ser interceptadas por terceros.
7) ¿Quiénes exactamente reciben tus fotografías?
8 ) Si enviaste una imagen, no lo vuelvas a hacer, será una cadena que jamás terminará.
9) Bloquea tus fotografías de las Redes Sociales, tal vez algunas sean comprometedoras y podrían afectar tu reputación en un futuro cercano.
10) Si sabes de alguien que está enviando o recibiendo fotografías, explícales el peligro, así estarás evitando que se propague esta práctica.
miércoles, 18 de octubre de 2017
T.P Bebidas Alcohólicas
Actividad 1
1)
4) La bebida fermentada se obtiene del natural proceso biológico de la fermentación alcohólica de frutos como la uva, la manzana o la cebada, que dan lugar a un alcohol, el etanol, componente principal de las bebidas alcohólicas.
A diferencia las bebidas destiladas se obtienen sometiendo las bebidas ya fermentadas al artificial proceso de destilación. Es un proceso de concentración de alcohol, consistente en su evaporación por calentamiento y posterior condensación por enfriamiento de las sustancias mas volátiles.
Esto lo que hace es aumentar la graduación de alcohol en una disolución alcohólica.
354 cm3 SL __________ X=19,47cm3 etanol
19,47 cm3. 0,8g/cm3 etanol= 15,57g etanol.
El etanol, al ser un oxigenante de las gasolinas, mejora su octanaje de manera considerable, lo que ayuda a descontaminar nuestras ciudades y a reducir los gases causantes del efecto invernadero.
Al ser un aditivo oxigenante, el etanol también reemplaza a aditivos nocivos para la salud humana, como el plomo y el MTBE, los cuales han causado el incrementado del porcentaje de personas afectadas por cáncer (MTBE) y la disminución de capacidades mentales, especialmente en niños (plomo).
El octanaje del etanol puro es de 113 y se quema mejor a altas compresiones que la gasolina, por lo que da más poder a los motores.
El etanol actúa como un anticongelante en los motores, mejorando el arranque del motor en frío y previniendo el congelamiento.
Aumenta el valor de los productos agrícolas de los que procede, mejorando así los ingresos de los habitantes rurales y, por ende, elevando su nivel de vida.
1)
La etiqueta de Heineken no cumple con la ley.
La etiqueta de Brahma si cumple con la ley.
La etiqueta de Campari si cumple con la ley.
La etiqueta de Pago de Carraovejas no cumple con la ley.
2) Significa que hay 5,5 cm3 de etanol cada 100 cm3 de solución.
3) 100 cm3 SL __________ 5,5 cm3 etanol
354 cm3 SL __________ X= 19,47cm3 etanol4) La bebida fermentada se obtiene del natural proceso biológico de la fermentación alcohólica de frutos como la uva, la manzana o la cebada, que dan lugar a un alcohol, el etanol, componente principal de las bebidas alcohólicas.
A diferencia las bebidas destiladas se obtienen sometiendo las bebidas ya fermentadas al artificial proceso de destilación. Es un proceso de concentración de alcohol, consistente en su evaporación por calentamiento y posterior condensación por enfriamiento de las sustancias mas volátiles.
Esto lo que hace es aumentar la graduación de alcohol en una disolución alcohólica.
Actividad 2
1) Para poder determinar el aporte calórico del etanol primero hay que tomar el volumen inicial del alcohol. Verter en un tubo de ensayo agua y después con un termómetro tomar la temperatura ambiente de ella. Después hay que encender el mechero de alcohol (etanol) y sostener con una pinza especial de madera el tubo de ensayo sobre la flama de fuego para que se caliente el agua. Cuando llega al punto de ebullición, es decir, cuando llega a los 100ºC quiere decir que el agua hirvió.
Finalmente para determinar las calorías que contiene el etanol debemos restar a la temperatura de ebullición la temperatura ambiente, y el volumen inicial del etanol menos el volumen final del mismo, así obtendremos las calorías del alcohol utilizado.
Finalmente para determinar las calorías que contiene el etanol debemos restar a la temperatura de ebullición la temperatura ambiente, y el volumen inicial del etanol menos el volumen final del mismo, así obtendremos las calorías del alcohol utilizado.
2)
1g etanol __________ 7kcal
40g etanol __________ X= 280 kcal (aporte calorico)
1g etanol __________ 7kcal
40g etanol __________ X= 280 kcal (aporte calorico)
3) 100 cm3 SL __________ 5,5 cm3 etanol
354 cm3 SL __________ X=19,47cm3 etanol
19,47 cm3. 0,8g/cm3 etanol= 15,57g etanol.
4) 1g etanol __________ 7 kcal
15,57g __________ X= 108,99 kcal
Actividad 5
- Al ser renovable y producido localmente, el etanol permite disminuir la dependencia del petróleo, lo que mejora la seguridad energética de los países.
martes, 19 de septiembre de 2017
domingo, 3 de septiembre de 2017
T.P Bolitas
Agua de la canilla (SL isotónica)
¿Qué ocurriría si se colocara un glóbulo rojo en agua destilada?
La membrana semipermeable del glóbulo dejaría pasar o transcurrir un movimiento de agua hacía el interior del mismo, provocando que se hinche y seguidamente reviente o estalle. El movimiento del agua destilada o del solvente en este caso a través de la membrana semipermeable, corresponde a un fenómeno llamado ósmosis.
Y la ósmosis del agua es particularmente importante para las células del organismo de los mamíferos y los seres humanos.
¿Qué ocurriría si se le colocara un glóbulo rojo en agua con sal?
La concentracion de sales de agua seria el medio hipertónico, ya que ésta contiene una concentración en sales mayor que la de los globulos rojos, y por tanto los globulos rojos serían el medio hipotónico.
En este caso el agua de los glóbulos rojos pasaría al medio hipertónico intentando reducir estas diferencias de salinidad. No estallarían sino que reducirían considerablemente su tamaño y forma pudiéndose hacer no funcionales.
Agua destilada (SL hipotónica)
¿Qué ocurriría si se colocara un glóbulo rojo en agua destilada?
La membrana semipermeable del glóbulo dejaría pasar o transcurrir un movimiento de agua hacía el interior del mismo, provocando que se hinche y seguidamente reviente o estalle. El movimiento del agua destilada o del solvente en este caso a través de la membrana semipermeable, corresponde a un fenómeno llamado ósmosis.
Y la ósmosis del agua es particularmente importante para las células del organismo de los mamíferos y los seres humanos.
¿Qué ocurriría si se le colocara un glóbulo rojo en agua con sal?
La concentracion de sales de agua seria el medio hipertónico, ya que ésta contiene una concentración en sales mayor que la de los globulos rojos, y por tanto los globulos rojos serían el medio hipotónico.
En este caso el agua de los glóbulos rojos pasaría al medio hipertónico intentando reducir estas diferencias de salinidad. No estallarían sino que reducirían considerablemente su tamaño y forma pudiéndose hacer no funcionales.
viernes, 4 de agosto de 2017
miércoles, 12 de julio de 2017
Interpretando curvas de solubilidad
1) Nos brinda la temperatura y g de soluto cada 100 g de agua (l).
2) Que a mayor temperatura va a haber mayor solubilidad.
3) Quedaría una solución aguada, con soluto totalmente disuelto.
4) Se va a transformar en una solución diluida (sistema homogéneo).
5) Sería 35g de soluto.
6) Solución saturada.
7) Quedará soluto sin disolver totalmente.
8) Va a quedar un sistema heterogéneo, solución saturada con soluto sin disolver.
Ejercicio
1) NH4 Cl
2) Es más soluble 110g de H2O, que sería el soluto KNO3.
3) Es menos soluble a 5g de H2O, que sería el soluto SO2.
4) A medida que en el amoníaco aumenta la temperatura la solubilidad es menor, y el nitrato de sodio cuando aumenta la temperatura su solubilidad es mayor.
5) Gases: HCl Sólidos: Kl KClO3
NH3 NaNO3 NaCl
SO2 KNO3
NH4Cl
KCl
6) La razón por la cual son necesarias bajas temperaturas para solubilidad del gas es que la temperatura es una medición de la entropía, o desorden ocasionado por la energía cinética de las moléculas de líquido y gas. Con baja entropía, los gases pueden formar débiles enlaces moleculares con las moléculas de agua. A medida que la temperatura aumenta, estos enlaces son muy débiles como para contrarrestar el movimiento de las moléculas. Como resultado, cuando la temperatura aumenta las moléculas de gas se elevan hacia la superficie y escapan dentro de la atmósfera.Una causa de confusión con respecto a cómo la temperatura afecta la solubilidad es que la regla se invierte para los solventes sólidos en el agua. A medida que la temperatura del agua aumenta, la solubilidad de una materia sólida aumenta. Esto es debido a que la entropía aumentada rompe los enlaces moleculares que mantiene unida a la materia sólida, ocasionando que se disuelvan dentro de una solución. Esta es la razón por la cual es más fácil disolver una taza de azúcar en agua caliente que en agua fría.
Problemas
1) Porque la solubilidad del azúcar aumenta a mayor temperatura, y disminuye a menor temperatura.
2) Calentar el agua.
3) O°C 100g H2O disuelve 38g NaCl (sal)
100g -------- 38g
838,75 a ------- x
550 x 305 x 5= 838,75
939,75 x 38 % 100= 318,725g.
La máxima cantidad es 318,725g.
Problemas
1) Porque la solubilidad del azúcar aumenta a mayor temperatura, y disminuye a menor temperatura.
2) Calentar el agua.
3) O°C 100g H2O disuelve 38g NaCl (sal)
100g -------- 38g
838,75 a ------- x
550 x 305 x 5= 838,75
939,75 x 38 % 100= 318,725g.
La máxima cantidad es 318,725g.
viernes, 7 de julio de 2017
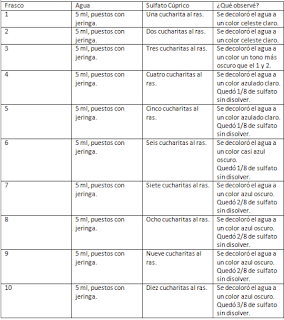
T.P Soluciones
1)
2)
- Una opción es que el agua haga espuma, la segunda es que el agua quede azul, la tercera que quede clara porque se purifica, y la cuarta que cambie el color a turquesa y quede mas espesa.
- Pensamos que cuanto mas sulfato le pongamos más oscura queda el agua (azul).
- HIPÓTESIS: cuanta más cantidad de sulfato tenga el agua, más oscura quedará.
3) El resultado fue que cuanto mas sulfato tenía más oscura quedaba el agua, aunque en los últimos números se mantuvo constante el color.
4) Si y no, porque a partir del 7 se mantiene constante el color, no cambia aunque tenga más cantidad.
5)
- El 1 y 2 tenían el mismo color (celeste claro).
- El 3 tenía un tono un poco más oscuro que el 1 y 2.
- El 4 y 5 ya eran un tono más azulado.
- El 6 es un tono casi azul oscuro.
- El 7,8,9 y 10 ya es azul oscuro.
Pensando juntos
1)
2) No, el sulfato y el cobre (cúprico).
3) No hay diferencias. Ya que todos usamos los mismos materiales y misma cantidad de ellos.
Suscribirse a:
Entradas (Atom)